由CAR-T为代表的免疫细胞疗法,为人类抗肿瘤药物事业添了浓墨重彩的一笔。但不得不说的是,免疫细胞疗法的可及性看起来并不高,诺华的Kymriah定价47.5万美元,吉利德kite的Yescarta定价37.3万美元,国内复星凯特的阿基伦赛注射液定价也高达120万人民币。时至今日,CAR-T疗法这只王谢堂前燕,看起来仍然很难飞入寻常百姓家。上述CAR-T细胞疗法的高昂定价,源于其不得不采用“私人订制”的方式来制备药物。于是不少研发者开始将目光转向通用型的细胞疗法,通过大规模制备的方式,使得成本大幅降低,从而降低用药价格。
通用型,off the shelf,是细胞疗法领域中被大家提及最多的关键词,指的是同种异体细胞疗法,即无需从患者自身体内分离免疫细胞,而是利用异体的免疫细胞,通过一定的改造及培养,再回输到患者体内(这里的通用型仅讨论通用型“T”,其他通用型“CAR”概念,比如亮氨酸适配体拉链CAR,与生物素结合免疫受体CAR,不在此讨论)。这一系列流程中技术玄机不少,在搞清楚前,让我们先来看看为什么普通的CAR-T细胞疗法必须要采用自体的方式。
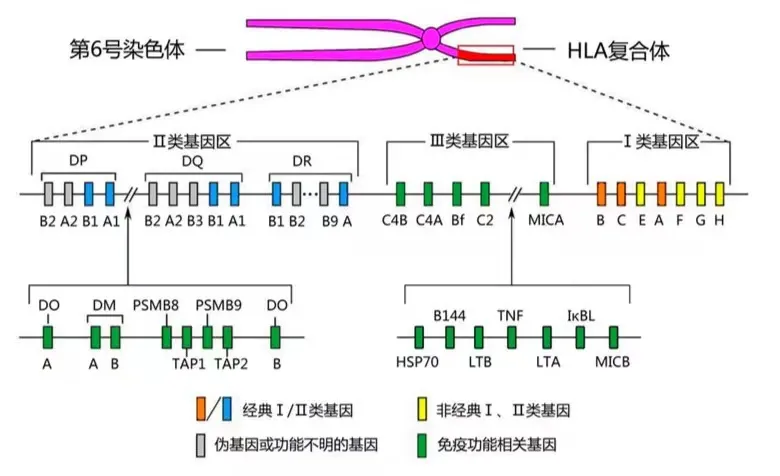
若异体CAR-T细胞直接输入到患者体内会发生两个事件,(1)患者机体本身的免疫系统将异体CAR-T细胞识别为外来物,消灭异体的CAR-T细胞,也就是排异反应(也称宿主抗移植物反应,HVGR);(2)异体的CAR-T细胞将整个患者视为“非我”,从而疯狂攻击患者的各个组织器官,也就是移植物抗宿主病(GvHD)。前者会使得CAR-T药物失去治疗效果,后者则有可能危及患者生命。那么为什么会发生上述两个事件呢,这与细胞的识别机制相关。脊椎动物基因组中有一类家族为主要组织相容性复合体(major histocompatibility complex,MHC),在人类中MHC又称人类白细胞抗原(human leukocyte antigen, HLA)。编码HLA的基因位于第6号染色体,分为三大类基因区,其转录翻译而成的蛋白质就是位于细胞表面的HLA抗原,HLA抗原是免疫细胞识别“自我”与“非我”的重要标志。所以说当进入人体的T细胞表面HLA配型和患者的免疫细胞表面HLA配型不一致时,就会发生上述的HVGR和GvHD。那么或许就有热心的朋友问了,HLA的基因座看起来并没有那么多,这世界上的人是否就可以分为多个群体,每个群体中的人HLA配型都一样,那么互相之间就可以异体T细胞回输了?想法很好,可是现实并非如此,事实上除了同卵双胞胎之外,世界上很难出现HLA完全相同的两个人。因为HLA复合体是人体基因多态性最丰富的系统,仅HLA-A这一个位点就有2000+种基因数,各个位点排列组合下来就是天文数字,这点在器官移植配型上体现的淋漓尽致。

大丈夫能屈能伸,既然正面刚不过,那就曲线救国,于是UCAR-T便应运而生。UCAR-T全称为Universal CAR-T,即通用型CAR-T。UCAR-T本质上是一种同种异体CAR-T细胞疗法,无需从患者体内分离T细胞,而是利用健康志愿者捐献T细胞,通过基因编辑技术,让其能够避免HVGR,同时避免GvHD,这当中十八般武艺各不相同,让我们一一了解。
解决GvHD
避免GvHD,其重要性不言而喻,其发生会对患者的组织器官造成强烈攻击,用药无效不要紧,倘若对患者会造成巨大损伤那就万分凶险了。因此研究者们首先想要解决的就是GvHD的问题。GvHD触发事件就是回输的T细胞表面TCR识别并结合了宿主器官细胞表面的HLA分子,并且这个回输T细胞发现,二者并不“契合”,于是开始发动攻击,造成GvHD。相对来说,解决GvHD并不难,目前有几种技术流派:
1 直接把TCR敲掉
克服GvHD最简单的方法,只要把回输T细胞的DNA中,表达TCR受体的基因敲除掉就可以。具体来说主要就是敲除TCRα亚基或β亚基的表达基因,实现手段就是几种常用的基因编辑方式,如ZFN、TALEN和CRISPR等。目前主流的UCAR-T都会做敲除TCR,当然也有一些该方法的变种,比如Celyad公司靶向NKG2DL的UCAR-T产品CYAD-101,并没有敲除TCR,而是在CAR之外,还转了表达TCR抑制性分子(TCR Inhibitory Molecule, TIM)进去,TIM的表达通过干扰CD3ζ的表达来减少TCR的形成,从而抑制了TCR的识别作用,这和敲除TCR有异曲同工之妙。当然,这里面的CAR设计也需要稍有不同,胞内信号区不能再使用CD3ζ了,而是需要改为使用CD3γ和CD3ε。CYAD-101的适应症是复发/难治性转移性结直肠癌,目前处于临床1期,预计今年下半年会报道临床数据。

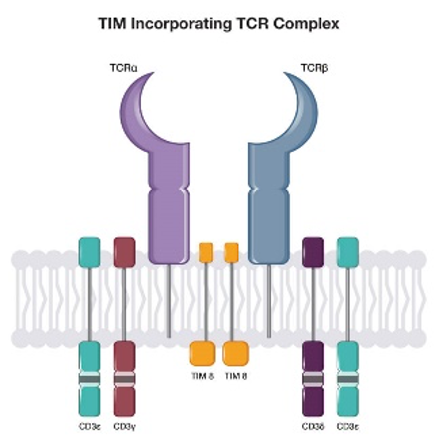
图片来源:Celyad公司官网
2 用其他细胞类型来代替
这里的“其他细胞类型”,主要有NK细胞与γδT细胞。先说NK细胞,NK细胞(natural killer cell)也叫自然杀伤细胞,能通过(a)释放穿孔素、颗粒酶,(b)表达CD95配体和TRAIL从而诱导靶细胞凋亡,(c)细胞因子介导杀伤,(d)ADCC等方式直接杀死目标细胞。为什么它能避免GvHD,就是因为NK细胞表面是不表达或极低表达TCR的(NKT细胞除外),它对细胞的杀伤不依赖于TCR,不会引起GvHD,是通用细胞疗法的好帮手,现在也有不少公司在做CAR-NK,并且取得一定成绩,但CAR-NK仍然存在诸多问题,比如有效性不够持久,CAR的设计更加困难,CMC较难等,这里不再赘述。除了NK细胞之外,γδT细胞也逐渐走上舞台。γδT细胞也是T细胞的亚型,其主要作用就是细胞毒性杀伤。γδT细胞并非不表达TCR,而是其表达的TCR不像常规T细胞一样由αβ亚基组成,而是由γδ亚基组成。γδT细胞本身就具有杀伤肿瘤作用,但是其对肿瘤细胞的识别并不依赖于TCR与MHC-1的结合(这也是为什么γδT细胞能用来避免GvHD),而是依赖于其细胞表面的独特受体NCR与肿瘤细胞表面的压力配体结合。现如今有不少公司在开发基于γδT细胞的肿瘤免疫疗法,包括直接用CAR-γδT,或开发相应双抗等等。此外还有Atara公司做的EBV T细胞,能用来治疗EBV相关疾病(安上CAR之后亦可扩发适应症范围)。但上述不敲TCR的方法,并未完全解决GvHD。关于NK、γδT、EBV T等细胞疗法,有兴趣的看官也可关注后续系列文章。
解决HVGR
解决了GvHD之后,下一个难啃的硬骨头就是HVGR了,这也是各个UCAR-T公司真正凸显实力的时候。HVGR就是患者的免疫细胞对输入体内的细胞发动攻击,这里面主要的“攻击者”有两类,即患者的T细胞,与患者的NK细胞。患者T细胞上的TCR识别并结合了回输T细胞表面的HLA,并且发现二者不“契合”,于是发动攻击。那么又有热心的朋友想问了,我把回输T细胞表面的HLA全部敲除行不行?答案是否定的,因为还有NK细胞的存在。NK细胞是体内的重要杀伤细胞,是没有特异选择性的,NK可以理解为一个“佩刀武士”,并且这名佩刀武士是“见人就砍,毫不留情”,能让他区分敌人友军的方式,就是目标细胞表面有没有表达一些抑制性分子(比如HLA-1类分子),如果一个细胞上有表达HLA-1类分子,那就会被NK识别为友军不予杀伤;倘若一个细胞上不表达HLA-1类分子,那就会被NK识别为敌人,进行杀伤(NK细胞的这一作用机制若要深究的话,是因为其表面会表达一些抑制性受体,而HLA-1类分子就是这些受体的配体,若二者结合则相安无事,否则就会触发NK细胞的missing self假说,产生杀伤)。因此,想通过敲除回输T细胞表面的HLA是行不通的(CD8+T细胞主要表达HLA-1类分子,较少表达HLA-2类分子)。回输的异体T细胞,不敲HLA是死路一条,敲了HLA还是死路一条,可谓困难重重,所以说解决HVGR就是UCAR-T公司的核心能力所在,目前也已经衍生出多种流派:
1 只敲TCR,不敲HLA,但配合清淋

图片来源:Cellectis公司官网
清淋就是化疗清除淋巴细胞,在自体CAR-T治疗之前常需要清淋,即在回输前5-10天开始给予患者一定剂量的氟达拉滨和环磷酰胺,回输前1-2天结束。目的是降低肿瘤负荷,并且给CAR-T细胞更多的增殖空间。UCAR-T的第一种技术路径也一定要伴随着清淋,因为这类UCAR-T并没有敲除HLA,因此必须先将人体的淋巴细胞压制在较低水平一段时间,在这段时间内患者的淋巴细胞较少,不足以对回输的异源T细胞产生足够强度的排异反应,故而回输的UCAR-T方能够得到扩增时机,并且在这段时间内发挥药效。这里就不得不提该领域的重要先驱法国Cellectis(NASDAQ:CLLS),公司的多款UCAR-T都采用TALEN基因编辑的方式,敲除TCRα的方式来克服GvHD,此外并没有敲除HLA,而是敲除了CD52,在回输之前的清淋采用氟达拉滨+环磷酰胺+阿伦珠单抗的化疗组合。其原因为:氟达拉滨+环磷酰胺这一普通清淋方式,所能维持的这段低淋巴细胞时期较短,大约1-2周左右,在这段时间内异源T细胞能够获得增殖机会,可一旦这一时间窗口过去,宿主免疫能力回升,则异源的UCAR-T细胞由于机体排异反应开始死亡,目前主流CAR-T在体内存活的中位数大概为3-4周。Cellectis希望延长这段低淋巴细胞时间窗口,从而让UCAR-T能在更长的时间内发挥疗效,因此给与靶向CD52的阿伦珠单抗,而CD52广泛表达于各种免疫细胞表面,阿伦珠单抗能够通过ADCC的方式杀死这些免疫细胞,也就是进一步加深了清淋的效果,使得UCAR-T的可作用时间窗口进一步延长。而敲掉回输T细胞上的CD52,就是避免阿伦珠单抗杀死回输的T细胞。在2015年,Cellectis的UCAR-T成功挽救了一名1岁大的AML婴儿患者,风光一时无两。不过Cellectis在2017年时由于UCART123导致一例患者死亡而被叫停,并于数月后修改临床方案后重新启动研究。2020年7月Cellectis的UCARCS1A又因为一名患者死亡而被叫停,这也一度使市场对UCAR-T赛道失去信心。Cellectis相关患者死亡案例的原因有多种猜测,可能是因为回输剂量过高,也有可能是制备的UCAR-T的脱靶率较高。当然这并非说明该技术路径走不通,国内外亦有部分企业采取该种技术路径,并做了系统性优化,仍然值得期待。这种路子说白了就是免疫抑制,所以需要引起注意的是,清淋压制了免疫系统之后对容易引起患者感染的风险。
2 敲TCR,同时敲B2M
HLA-1类分子的结构大致由两部分组成,即α链(由α1、2、3组成)和β链,β链是非MHC分子β2微球蛋白(B2M),其编码基因位于人体15号染色体上。HLA-1类分子的形成依赖由α链和β链形成异源二聚体,当敲除B2M对应的基因后,B2M无法转录翻译出来,α链也就无法和β链形成二聚,因此细胞膜上α链也没法单独稳定存在,这就意味着细胞膜上不会存在HLA-1类分子,即:敲了B2M就意味着敲了整个HLA-1。瑞士公司CRISPR Therapeutics(NASDAQ:CRSP)就是采用了这样的技术路径,通过CRISPR同时敲除TCR和B2M。敲了B2M可以完美逃过宿主T细胞的攻击,但是如前所述,缺乏HLA-1的细胞会被NK细胞识别并杀死,所以若要取得良好的效果,则需要在清淋上下更多的功夫。CRISPR设计了独特的清淋方案,也取得了不错的临床效果,但依然要警惕可能带来的感染风险。

图片来源:CRISPR Therapeutics公司招股书
3 敲TCR,敲HLA-1,同时转入抑制性基因
随着越来越多HLA-1敲除的产品得到研发,缺失HLA-1分子的UCAR-T细胞容易被NK细胞杀死这件事,得到了更加充分的认知。看NK的名字就知道它是个狠人,这个“佩刀武士” 砍起人来,连它自己都怕,于是不少研发者将目光聚焦于再转一个抑制性基因进UCAR-T细胞,从而表达出抑制性的配体分子,让回输的UCAR-T被NK识别为“友军”,从而避免被NK细胞杀死。那么转什么样的抑制性基因合适呢?这里就需要先研究一下NK细胞表面的受体类型了,NK细胞表面的受体大致可分为两类,一类是激动性受体(NK细胞的油门),一类是抑制性受体(NK细胞的刹车),因此理论上讲,只要给UCAR-T细胞基因组里导入抑制性受体的配体,就能够避免被NK细胞杀死。比如非经典的HLA分子,起到替代HLA-1的作用,这里常用的有导入HLA-E(与NKG2A/CD94复合物结合)、HLA-G(与KIR2DL4结合)、siglect 7、siglect 9等。但是这种方式仍然存在局限性,比如最常导入的HLA-E的策略,这种方式只能够阻止NK细胞的亚群---NKG2A阳性NK的攻击,但是对其他NK亚群(例如KIR2DL1-4阳性的NK细胞)的攻击就不能阻止了,因为KIR2DL1-4阳性NK细胞需要通过HLA-C或HLA-G才能阻止。
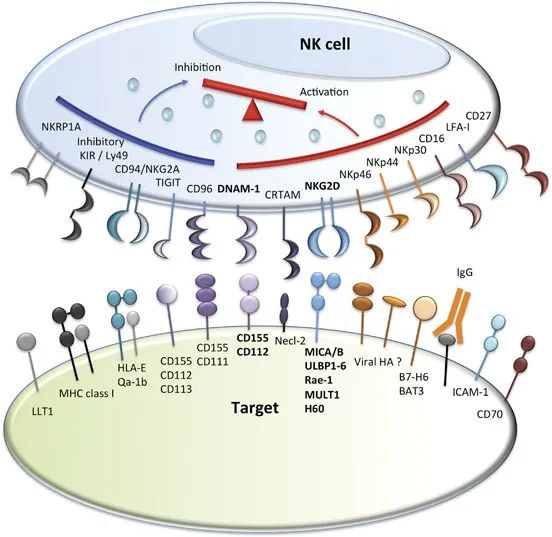
图片来源:Cell Death & Differentiation volume 21, pages5–14 (2014)
4 敲TCR,同时把防御机制工程化到T细胞上
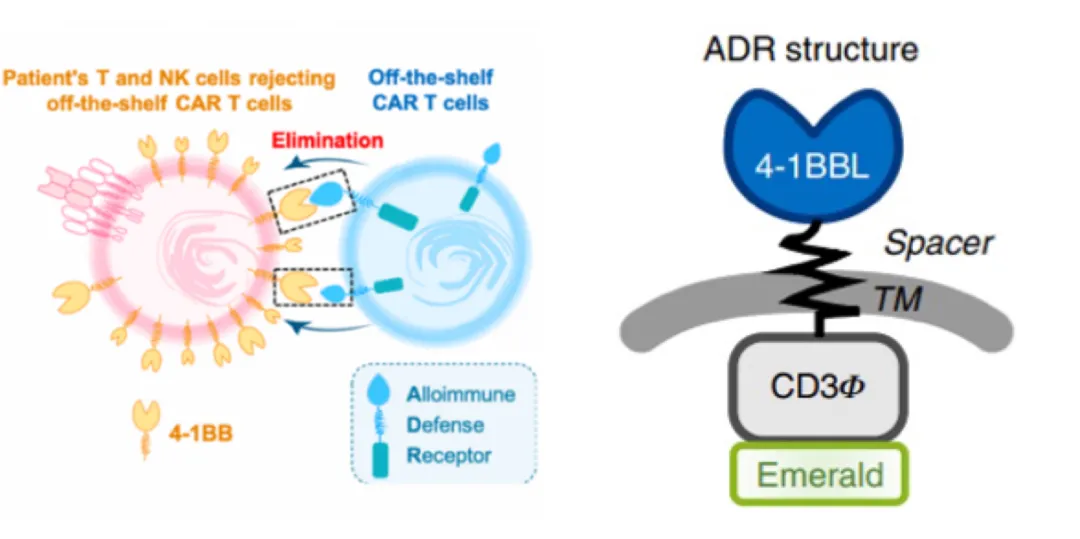
图片来源:Nature Biotechnology volume 39, pages 56–63 (2021)
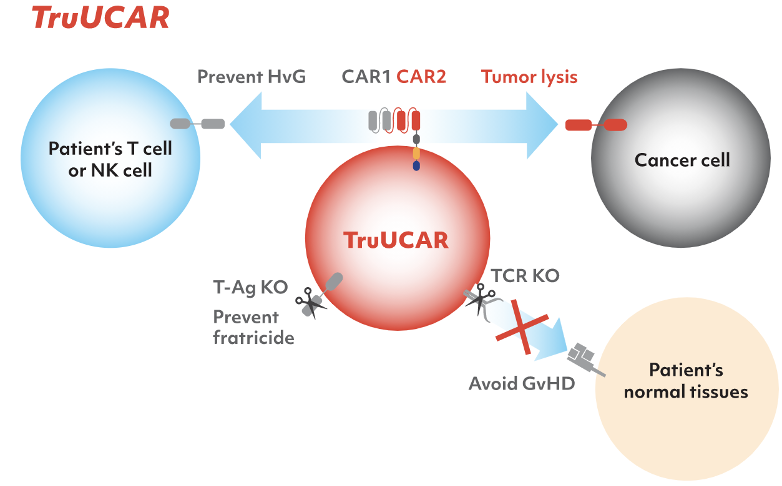
图片来源:亘喜公司官网
这种流派发现及应用时间尚短,但机制非常新颖有趣,未来潜力不小。比如有一种方式是将免疫防御受体(alloimmune defense receptor, ADR)工程化到T细胞上去。活化的淋巴细胞,包括T细胞与NK细胞表面,会高表达4-1BB(CD137),而当这些淋巴细胞不再活化时,4-1BB又再次下调,也就是4-1BB是区分活化/非活化淋巴细胞的重要标志物,而HAGV就是由活化的淋巴细胞攻击回输的异体细胞造成,所以说,如果能够除去这些活化的淋巴细胞,就能避免HAGV。所以这种流派的做法就是转进入CAR的同时,还转了一个ADR进去,当然,若想成功应用,TCR还是需要敲的。这个ADR说白了其实就类似一代的CAR,只不过把scFv部分换成了4-1BB的配体,也就是说ADR使得T细胞能直接靶向高表达4-1BB的活化T/NK细胞,进而杀死这些活化的T/NK细胞。此外还有亘喜的TruUCAR平台也是在做相似的事,他们设计的CAR具有双特异性。其中一种CAR是用于防御宿主免疫细胞的杀伤的,也就是靶向并杀死宿主的激活T细胞核NK细胞。另一种CAR则用来靶向并杀死肿瘤细胞。其实他们做的事,就是用回输T细胞本身进行“另一种清淋”,而不是用化疗药物来清淋。这么做的好处就是清淋效果持久,选择性更好(只杀死活化的淋巴细胞)。但也有风险存在,就是清淋效果太久,只要回输的T细胞不死,那么机体就要长期处于免疫抑制的状态,这或许为肿瘤患者会带来风险。
5 敲TCR,同时敲除部分HLA-1分子
在介绍这种流派之前,我们先来讲一下器官移植。在组织器官移植配型当中,供体与受体的配型是不需要完全一模一样的(否则世界上可能就没多少人能配型成功)。在HLA配型报告中,会重点关注HLA-A、HLA-B、HLA-DR三个基因座的6个位点,并且这6个位点尽量多配,但不强求。这是因为并非所有的HLA分子,都对免疫排斥反应同等重要。在诸多HLA-1类分子当中,其中HLA-A是对免疫排斥最重要的标志物,也就是说宿主与供体的HLA-A倘若错配,发生HVGR的风险极大,倘若宿主与供体的HLA-A相合,就只有很小的几率发生HVGR。说回这种UCAR-T的流派,就是利用了HLA-A的重要性。具体方式是敲除细胞TCR的同时,选择性敲除HLA-A,而非敲掉整个HLA-1类分子。这种方式的好处是,保留其余HLA-B和HLA-C,此时宿主的NK和T细胞不会杀伤回输的细胞。并且HLA-B和HLA-C的错配,反而能够改善肿瘤患者的复发情况和总生存期,是种一举两得的策略。
UCAR-T具有太多的优势,(1)健康供体效果更好。很多肿瘤患者在给与细胞疗法的时候,患者T细胞已暴露在多次放化疗、癌症的免疫效应或其他潜在自身免疫疾病中,自体的T细胞大都已发生耗竭。此时再从外周血中提T细胞予以改造,得到的“士兵”也往往战斗力不足。尤其是面临实体瘤这一巨大难关时,倘若自体的CAR-T细胞战斗力不足,则更加难以发挥作用。UCAR-T细胞取材自健康供体的T细胞,此时T细胞改造得到的“士兵”能力也更强,更能在实体瘤中发挥疗效;(2)现货供应及时治疗。自体CAR-T制备周期长达2-3周,延误病人获得治疗的时间,而UCAR-T作为现货型疗法,能够在第一时间给与患者用药;(3)价格便宜人人可用。自体CAR-T的昂贵价格,如果没有医保支持,很多患者会难以负担。倘若有一款优质的UCAR-T产品成功上市,其价格有可能会低于5万元人民币,这将使得细胞治疗的渗透率极大提升,惠及更多的患者;(4)批量生产稳定可控。不过UCART虽有千般好,但是想成功采摘这朵悬崖峭壁上的“天山雪莲”,还需完美跨过GvHD和HVGR两大难关。目前UCAR-T领域各种武功百花齐放,希望能尽早取得成功,真正改写细胞疗法的历史,真正造福全世界的广大患者。



